|
Dans le domaine de la Cytogénétique, Le CRIE travaille en collaboration avec le laboratoire de Cytogénétique, d’Histologie et d’Embryologie de l’Hôpital Cochin à Paris, dirigé par le Pr Jean-Michel DUPONT.
La plupart des travaux présentés dans cette rubrique sont issus de ce laboratoire dans lequel nous avons été initié à cette discipline.
Tout examen de cytogénétique du CRIE est soit effectué à l’Hôpital Cochin, soit validé par lui. Ce qui confère une grande fiabilité à nos examens.
Rappelons simplement que 60% des fausses couches spontanées (FCS) du premier trimestre sont dues à des anomalies chromosomiques.
L’examen du caryotype permet la plupart du temps d’en identifier l’origine.
|
Qu’est que la Cytogénétique ?
La cytogénétique ou génétique chromosomique est l’étude des chromosomes humains dans le but de diagnostiquer les anomalies chromosomiques.
On appelle anomalie chromosomique tout remaniement du nombre ou de la structure des chromosomes.
Ces remaniements peuvent s'observer de manière constitutionnelle (ils sont alors présents dès la naissance) soit de manière acquise au cours de processus malins (ils ne sont observés alors qu'au niveau des cellules tumorales). Ils peuvent impliquer un ou plusieurs chromosomes.
La cytogénétique se subdivise en 2 entités qui sont :
-La cytogénétique conventionnelle basée sur la lecture et l’interprétation du caryotype avec :
- La cytogénétique constitutionnelle:
- La cytogénétique prénatale
-La cytogénétique moléculaire constitue une utilisation de la spécificité de l'appariement base à base de la molécule d’ADN pour identifier précisément un chromosome entier ou même un simple fragment à l’aide de sonde moléculaire marquée chimiquement.
Qu’est qu’un Caryotype ?
C’est la représentation de l'ensemble des chromosomes contenu dans le noyau d’une cellule, de leur ordonnancement (taille), obtenus par microscopie ou microphotographie et de la formule qui en découle. L’être humain possède 23 paires de chromosomes comprenant 22 paires de chromosomes dits autosomes et une paire de chromosomes appelés chromosomes sexuels ou encore gonosomes représentée par XX chez la femme et XY chez l’homme. C’est l’isolement, le positionnement par paires de ces différents chromosomes que l’on appelle Caryotype ou Caryogramme. On réalise des caryotypes dans le but de détecter des aberrations chromosomiques (comme la trisomie 21) ou d'identifier certains aspects du génome de l'individu, comme le sexe (XX ou XY).
Quand doit-on faire un examen de caryotype ?
-D’une façon générale dans les pathologies cancéreuses des cellules du sang
-Chez le fœtus (Diagnostic Prénatal)
- Age maternel : 38 ans révolus le jour de la ponction
- Couple ayant déjà eu un enfant porteur d’une anomalie chromosomique
- Anomalie chromosomique portée par l’un des deux parents
- Signe d’appel échographique
- RCIU
- Hydramnios ou oligoamnios
- Malformation(s)
- Petits signes évoquant une Trisomie 21,
- Diagnostic de sexe pour une maladie liée à l’X
- Signe d’appel biologique (risque supérieur ou égal à 1/250)
- Chez le nouveau né :
- Petit poids de naissance
- Syndrome dysmorphique
- Ambiguité sexuelle
- Hypotonie
- Syndrome malformatif
- Chez l’enfant :
- Retard staturo pondéral
- Retard psycho-moteur : retard des acquisitions motrices ou de langage.
- Chez l’adolescent :
- Retard pubertaire
- Gynécomastie
- Chez l’adulte :
- Fausses couches à répétition
- Stérilité
- Hypofécondité avec anomalies du spermogramme
- Aménorrhée primaire ou secondaire
- Antécédents familiaux d’anomalies chromosomiques
- Couple devant bénéficier d’une fécondation in vitro
Les Principaux Syndromes Cytogénétiques
1) Anomalies des autosomes
Trisomie 21 (Syndrome de Down)
Fréquence : 1 pour 800 naissances vivantes ; le risque augmente en fonction de l'âge maternel
Diagnostic chez le nouveau-né sur l'association Hypotonie + dysmorphie
Clinique
.Dysmorphie :
- Tête petite, arrondie, faciès rond, profil plat
- Fentes palpébrales obliques en haut et en dehors
- Oreilles petites, mal ourlées
- Bouche petite avec protrusion de la langue, voûte palatine ogivale
- Petites taches pigmentées en périphérie de l'iris (taches de Brushfield)
- Mains avec doigts courts et brachymésophalangie (briéveté de la 2°phalange) et clinodactylie (déviation latéro-dorsale) surtout du 5° doigt.
- Pli palmaire transverse unique
.Malformations associées fréquentes :
- cardio-vasculaires (dans 50% des cas)
- digestives, surtout atrésie ou sténose duodénales
.Encéphalopathie se traduisant par un déficit mental d'intensité variable :
le QI se situe autour de 50 à l'âge de 5 ans et décroît ensuite le plus souvent. Difficultés d'acquisition du langage et encore plus de la lecture et de l'écriture.
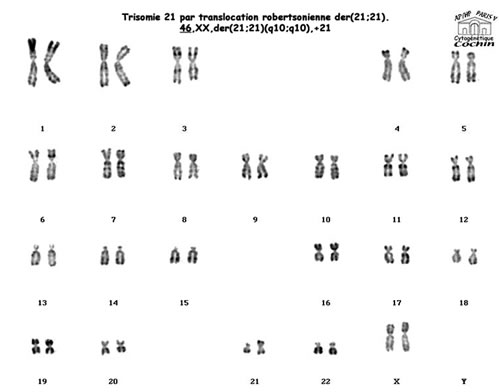
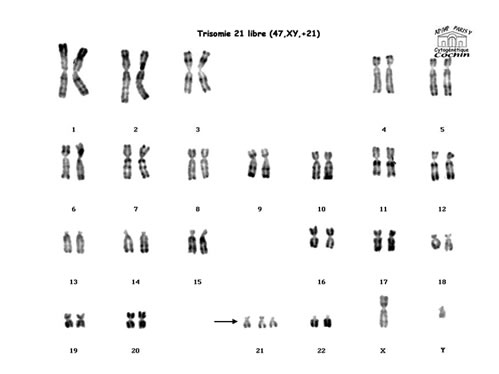
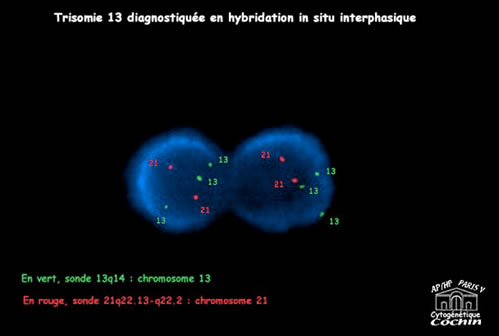
Cytogénétique
Il s'agit dans 95% des cas d'une trisomie libre (Chromosome 21 surnuméraire avec formule 47,XX,+21 ou 47,XY,+21)
 |
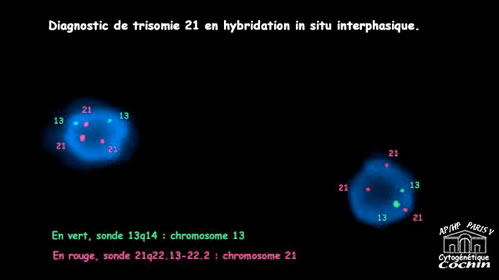 |
; dans les autres cas d'une trisomie 21 par translocation , le chromosome 21 surnuméraire étant transloqué sur un autre chromosome acrocentrique , 14 le plus souvent : 46,XX,t(14;21) ou 46,XY,t(14;21), parfois aussi 21
ou 22. Ces anomalies chromosomiques sont en mosaïque dans 2,5 % des cas, la gravité de l'atteinte clinique est indépendante de la proportion observée de cellules trisomiques.
Diagnostic prénatal
Le diagnostic de certitude est possible par étude du caryotype foetal, mais les indications sont parfois difficiles à poser dans des situations à risque faible
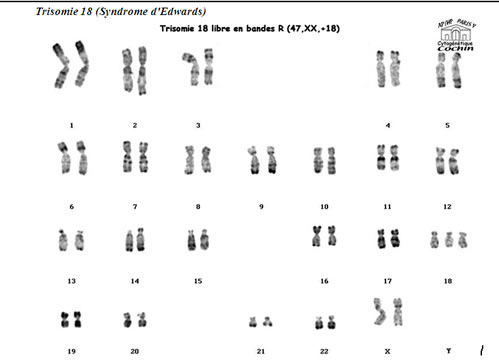
Fréquence : 1/9 000 naissances
Clinique
Hypoplasie des bourgeons maxillaire et mandibulaire
Dolichocéphalie,
Microrétrognathie
Implantation basse des oreilles, mal ourlées, aspect faunesque
Attitude en suppliant des membres supérieurs
Pouce, index et auriculaire recouvrant IIIe et IVe doigts
Pieds en piolet
Cardiopathie fréquente (CIA, CIV)
Malformattion paroi abdominale (omphalocéle)
Mort précoce
Diagnostic prénatal possible sur signe d'appel échographique :
malformations et retard de croissance (RCIU) débutant au 2° trimestre.
 |
 |
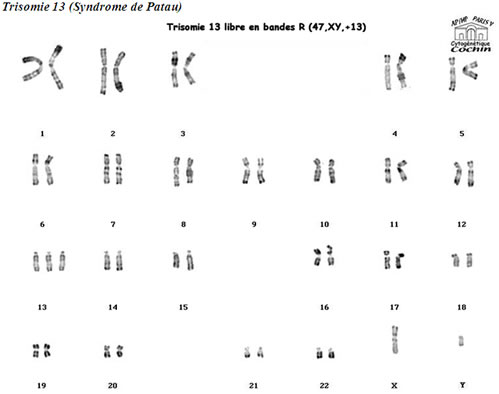
Fréquence : 1/20 000 naissances
Clinique :
Holoprosencéphalie et Hypoplasie du bourgeon frontal
Forme majeure : Cyclopie, Anophtalmie, Proboscis
Forme classique : Hypotélorisme, Microphtalmie
Bec de liévre, Gueule de loup (fente labiale et palatine)
Front fuyant,
Ulcérations du cuir chevelu
Angiomes
Malformations diverses :
oculaires,
cérébrales
cardiaques (CIA, CIV)
génitales (cryptorchidie, utérus bifide)
hernie ombilicale
hexadactylie, pieds en piolet
spina bifida
Mort précoce (quelques mois)
Diagnostic prénatal possible sur dépistage échographique des malformations.
Délétion partielle 5p (Maladie du cri du chat)
Fréquence : 1/50 000 à 1/100 000 naissances
Clinique :
Rarement létal
Débilité profonde
Langage inexistant
Hypotrophie
Dysmorphie faciale
Chez le nourrisson :
Cri aigu et plaintif (rappelant le miaulement d'un chat)
Microcéphalie,
Visage lunaire
Hypertélorisme et épicanthus
Micrognathie
Chez l'enfant :
Visage étroit
Petite mandibule
Malformations du larynx
Cytogénétique : del(5)(p14p15)
2) Anomalies des gonosomes
47,XXY :Syndrome de Klinefelter
Fréquence : 1/1.000 garçons (mosaïques comprises)
Pas de rôle de l'âge parental
Clinique :
Signes principaux :
Atrophie testiculaire
Gynécomastie
Stérilité
Pas de dysmorphie importante
Diagnostic posé :
à la puberté le plus souvent
parfois pour stérilité
rarement à la naissance, rarement chez le jeune enfant (parfois pour malformation non spécifique des organes génitaux externes).
Phénotype :
Atrophie testiculaire : constante - testicules petits, mous contraste ; avec scrotum de taille et de pigmentation normale.
Verge le plus souvent normale, parfois hypoplasique
Gynécomastie : n'est pas constante (1/3 à 1/4 des cas) ; apparaît vers 12-13 ans, volume modéré, au début asymétrique.
Autres anomalies des caractéres sexuels secondaires : pilosité rare, répartition gynoïde des graisses
Stérilité : azoospermie pratiquement constante.
Morphologie du sujet : variable. Soit sujets longilignes, avec membres longs, soit sujets de morphologie masculine normale (sujets parfois même de petite taille)
Développement intellectuel normal dans la majorité des cas ; cependant certains sujets peuvent présenter des difficultés scolaires et d'inadaptation sociale ou des troubles psychotiques.
Dosages hormonaux
Pas de modification des sécrétions hormonales avant la puberté
FSH élevée à partir de la puberté
Testostérone normalement secrétée, mais diminution spontanée autour de 30 ans.
Cytogénétique :
Dans 85 % des cas, l'anomalie est homogène : 47,XXY dans toutes les cellules.
Les autres cas sont des mosaïques 47,XXY/46,XY ou 47XXY/46XX
47,XYY
Fréquence : 1/1.000 garçons
Clinique :
Phénotype peu caractéristique :
taille le plus souvent supérieure à la normale
fonction testiculaire normale, fécondité normale, descendance normale
Pas de conséquence sur la méiose : la régulation se ferait au cours des mitoses de multiplication des spermatogonies, éliminant l'Y surnuméraire. Un seul chromosome Y est retrouvé dans la plupart des spermatocytes I.
Développement psychique :
QI : normal
Excès d'affectivité ou agressivité ; intolérance à la frustration
45,X : Syndrome de Turner
Fréquence : 1/10 000 filles à la naissance (cependant, fréquence beaucoup plus élevée à la conception). Pas de rôle de l'âge parental
Diagnostic posé :
soit à la naissance ou chez le nourrisson : syndrome de Bonnevie-Ulrich
Petite taille (45-47 cm) ou même hypotrophie
Lymphoedéme du dos, des mains et des pieds
Excès de peau sur la nuque
soit chez la petite fille
soit chez l'adolescente
Clinique
Signes principaux
Petite taille (1 m 50)
Impubérisme
Agénésie ovarienne
Maformations somatiques évocatrices
Dysmorphie prononcée, généralement évocatrice, avec nombreux signes cependant rarement tous présents chez un même sujet.
Dysmorphie cranio-faciale :
fentes palpébrales obliques en bas et en dehors,
commissures labiales, ptosis, voûte palatine ogivale
micro-rétrognathisme, oreilles bas implantées.
Cou, thorax, abdomen :
pterigium coli, cou court, large, épais
implantation basse des cheveux
thorax large en bouclier, mamelons hypoplasiques, écartés.
Membres :
M.S : cubitus valgus, raccourcissement du 4è et du 5è métacarpien
M.I : écrasement du plateau tibial interne
Organes génitaux - Endocrinologie :
OGE : restent infantiles
OGI : utérus hypoplasique, gonades atrophiques
Aménorrhée Iaire
Pilosité pubienne réduite, axillaire absente.
Développement mammaire réduit ou absent.
FSH élevée ; 17 céto stéroïdes diminués
Peau, phanères :
fréquence des naevi pigmentaires
Malformations viscérales
cardiaque : coarctation de l'aorte (20 % des cas de la forme classique 45,X).
rénale : rein en fer à cheval, défaut de rotation, hypoplasie ou agénésie
squelettique : genou, poignet, main, retard de l'âge osseux, selle turcique petite
Organes des sens : myopie sévère, cataracte congénitale, surdité congénitale ou troubles de l'audition
Développement psychomoteur : extrêmement variable
soit débilité légére
soit QI normal
Caractères et maladies liés au sexe :
Daltonisme, Hémophilie Myopathie...Se retrouvent avec la même fréquence que dans le sexe masculin.
Formes génétiques :
55 % des cas formule 45 X.
Pas de corpuscule de Barr : test de Barr -
Le chromosome X présent est d'origine maternelle dans 76 % des cas.
45 % des cas restants sont des variantes de nombre ou de structure
mosaïques : 46, XX/45,X
anomalies de structure, homogénes ou en mosaïque :
isochromosome X : 46,X,i(Xq)
délétions : del Xp, del Xq
anneau de l'X : 46,X,r(X)
Reproduction
Possibilité de grossesse qui restent cependant exceptionnelles:
chez des femmes : 45, X homogène, ou en mosaïque,
chez des femmes avec anomalies de structure de l'X.
Risque génétique élevé ~ 80 %
avortements spontanés +++
morts nés, malformations viscérales
aberrations de type turnerien, autres aberrations chromosomiques
Seuls environ 1/3 des enfants nés vivants ont été considérés comme normaux.
Syndrome de Noonan
Défini par un phénotype turnerien et un caryotype normal (46,XX ou 46,XY)
Syndrome de cause génique - Transmission Dominante autosomique
Fonction gonadique variable (depuis agénésie gonadique jusqu'à développement gonadique normal et fertilité)
47,XXX
Fréquence : 1/1 000 filles
Clinique :
Phénotype, puberté et fertilité habituellement normaux
QI : Normal ou légérement diminué.
Maîtriser les indications du caryotype
1) Quand demander un caryotype standard ?
1.1 Diagnostic prénatal
L'examen peut être réalisé soit sur villosités choriales dès la 11e - 12e semaine d'aménorrhée, soit sur amniocytes à partir de la 14e - 15e semaine, soit enfin sur sang foetal après la 20e semaine. Ces techniques de prélèvement invasives sont toutes associées à un risque de fausse couche (0,5 % - 1 % des cas pour l'amniocentèse, 1 % à 1,5 % pour la biopsie de villosité choriale, 3 % - 5 % pour la ponction de sang foetal) qui les réservent à des situations associées à un risque accru d'anomalie chromosomique foetale. Ces indications sont précisées dans un texte de loi
. âge maternel supérieur ou égal à 38 ans le jour de la ponction
. signe d'appel biologique (risque calculé supérieur à 1/250 après dosage des marqueurs sériques)
. signe d'appel échographique (toute anomalie morphologique pourra donner lieu à une prise en charge de l' amniocentèse , mais toutes les anomalies échographiques ne sont pas des indications au caryotype prénatal)
. antécédent d'enfant porteur d'une anomalie chromosomique
. caryotype parental remanié
. diagnostic de sexe pour les maladies liées à l'X sans diagnostic possible par biologie moléculaire
1.2 Diagnostic constitutionnel
Le caryotype constitutionnel n'est pas soumis à une législation particulière comme le diagnostic prénatal. Les indications peuvent donc être très diverses et nous nous limiterons aux plus fréquentes.
. syndrome polymalformatif, dysmorphie faciale, retard mental, isolés ou associés
. clinique évocatrice d'un syndrome chromosomique
. infécondité, fausses couches à répétition
. ambiguïté sexuelle, transsexualisme
. enquête familiale lors de la découverte de certaines anomalies équilibrées ou déséquilibrées
1.3 Hématologie, cancérologie
Les processus cancéreux sont très souvent associés à des remaniements chromosomiques, parfois spécifiques ( chromosome Philadelphie de la leucémie myéloïde chronique par exemple, qui résulte d'une translocation t(9;22) ).
Au cours des processus tumoraux, le caryotype peut donc présenter un intérêt
. diagnostic (mise en évidence d'une anomalie spécifique d'une pathologie)
. pronostic (certaines formules chromosomiques sont associées à des formes d'évolution favorables ou au contraire défavorables)
. thérapeutique notamment en hématologie ou il permet d'évaluer la maladie résiduelle et donc l'efficacité du traitement.
2) Quand demander un caryotype en haute résolution ?
Le caryotype en haute résolution est un examen de deuxième intention, toujours réalisé après un caryotype standard. Son indication est posée dans deux situations principales :
* préciser les points de cassures d'un remaniement dépisté sur un caryotype standard ;
* rechercher un micro remaniement quand la clinique évoque très fortement l'existence d'une anomalie chromosomique alors que le caryotype standard est normal. Dans cette situation, la haute résolution présente l'avantage sur la cytogénétique moléculaire de pouvoir analyser tous les chromosomes, sans avoir à être précisément orienté vers une région particulière au préalable.
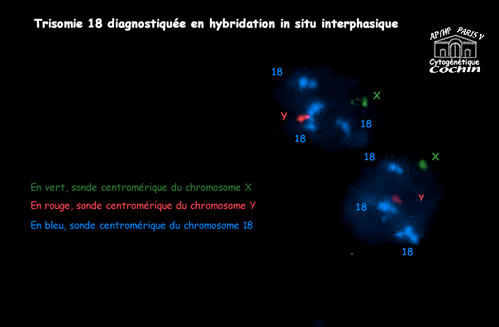
3) Quand demander un examen en cytogénétique moléculaire ?
L'utilisation de sondes moléculaires en cytogénétique est le plus souvent décidée dans le but de préciser une anomalie découverte ou suspectée lors d'un caryotype standard ; il s'agit donc le plus souvent d'un complément technique mis en oeuvre par le laboratoire. Il existe cependant des situations ou l'hybridation in situ ( FISH pour Fluorescence in situ Hybridisation) est réalisée de première intention : c'est le cas des syndromes microdélétionnels pour lesquels cette technique est le moyen le plus fiable de faire le diagnostic.
En pratique cependant, seules certaines régions du génome sont accessibles à une analyse de routine, celles qui sont impliquées avec une certaine fréquence dans des syndromes cliniques et pour lesquelles des sondes existent déjà.
Principaux syndromes microdélétionnels accessibles au diagnostic en routine :
 Syndrome de Wolff Hirschorn (délétion 4p) Syndrome de Wolff Hirschorn (délétion 4p)
 Syndrome du Cri du Chat (délétion 5p) Syndrome du Cri du Chat (délétion 5p)
 Syndrome de Williams (délétion 7q) Syndrome de Williams (délétion 7q)
 Rétinoblastome (délétion 13q) Rétinoblastome (délétion 13q)
 Syndromes de Prader Willi et Syndrome d'Angelman (délétion 15q) Syndromes de Prader Willi et Syndrome d'Angelman (délétion 15q)
 Syndrome de Smith Magenis (délétion 17p) Syndrome de Smith Magenis (délétion 17p)
 Syndrome de Miller Dieker (autre délétion 17p) Syndrome de Miller Dieker (autre délétion 17p)
 Syndrome de DiGeorge, Syndrome Vélo cardio facial (délétion 22q) Syndrome de DiGeorge, Syndrome Vélo cardio facial (délétion 22q)
 Syndrome de Kalmann (délétion Xp) Syndrome de Kalmann (délétion Xp)
 Syndrome de Léri Weill (délétion de l'extrêmité terminale des chromosomes X ou Y) Syndrome de Léri Weill (délétion de l'extrêmité terminale des chromosomes X ou Y)
|